Первый и второй законы термодинамики
Первый закон термодинамики.
Формулировка:
В изолированной термодинамической системе сумма всех видов энергии является величиной постоянной.
Этот закон является частным случаем всеобщего закона сохранения и превращения энергии, который гласит, что энергия не появляется и не исчезает, а только переходит из одного вида в другой. Из этого закона следует, что уменьшение общей энергии в одной системе, состоящей из одного или множества тел, должно сопровождаться увеличением энергии в другой системе тел. Существую другие формулировки этого закона:
- Не возможно возникновение или уничтожение энергии (эта формулировка говорит о невозможности возникновения энергии из ничего и уничтожения ее в ничто).
- Любая форма движения способна и должна превращаться в любую другую форму движения (эта философская формулировка подчеркивает неуничтожимость энергии и ее способность взаимопревращаться в любые другие виды энергии).
- Вечный двигатель первого рода невозможен. (Под вечным двигателем первого рода понимают машину, которая была бы способна производить работу не используя никакого источника энергии).
- Теплота и работа являются двумя единственно возможными формами передачи энергии от одних тел к другим.
Энтальпия
В прошлом столетии Гибсс ввел в практику тепловых расчетов новую функцию - энтальпию.
Определение: Энтальпия это сумма внутренней энергии тела и произведения давления на объем.;
I = U + PV;
где: I – энтальпия; U –внутреней энергия; P – давление; V -объем.
Удельная энтальпия i это отношение энтальпии тела к его массе. Удельная энтальпия это параметр состояния. Значение удельной энтальпии пара и воды при определенном давлении и температуре можно найти в справочнике. Пользуясь этими данными, можно определить количество теплоты участвующее в процессе или работу процесса.
Энтропия
Теплота q не является функцией состояния, количество теплоты выделившейся или поглотившейся в процессе зависит от самого процесса. Функцией состояния является энтропия обозначается S размерность [Дж/К]
dS = dQ/T
где dS – дифференциал энтропии; dQ – дифференциал теплоты; Т – абсолютная температура;
Удельная энтропия - отношение энтропии тела к его массе. Удельная энтропия s является справочной величиной. Удельная энтропия - функция состояния вещества, принимающая для каждого его состояния определенное значение:
s = f (Р, v, Т) [Дж/(кг x K)]
Тепловая Т- S диаграмма.
Удельную энтропию можно применять совместно с одним из основных параметров для графического изображения процессов. Аналогично тому как мы строили изменение объема в зависимости от изменения температуры мы можем изобразить некоторый процесс изменения энтропии и температуры в Т- S координатах. В этом случае любая точка на графической плоскости соответствует определенному состоянию рабочего тела, а линия от точки 1 до точки 2 отображает некий термодинамический процесс. Особенностью Т- S координат является то, что площадь под линией процесса соответствует количеству энергии отданной или полученной рабочим телом.
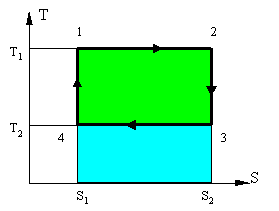
Рисунок 5 - Т – S диаграмма цикла Карно
На данной диаграмме (рисунок 5) представлен некий замкнутый цикл. Система последовательно переходит из точки 1 в 2 затем 3, 4 и снова в 1. Из графика видно, что процесс 1 => 2 является изотермическим (происходит при Т1 = const) и процесс 3 => 4, также является изотермическим (происходит при T2=const). Процессы 2 => 3 и 4 => 1 являются адиабатными, поскольку в них не происходит изменение энтропии то dS = 0, следовательно dQ = 0 или Q = const. Причем в процессе 2 => 3 происходит охлаждение рабочего тела за счет совершения работы телом, а в процессе 4 => 2 происходит нагрев рабочего тела, за счет совершения работы над телом.
Количество тепла подводимое к системе: Q1 = T1 × (S2-S1) - площадь прямоугольника 1-2-S2-S1-1 (вся область закрашенная голубым и зеленым).
Количество тепла отдаваемое системой: Q2 = T2 × (S2-S1) площадь прямоугольника 3-S2-S1-4-3 (область закрашенная голубым цветом).
Работа цикла - разность подведенной и отведенной теплоты: L = Q1 - Q2 (область закрашенная зеленым).
К.П.Д цикла:
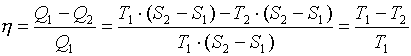
Главной особенностью данного цикла является то, что при данном перепаде температур у любого другого цикла КПД будет меньше. Другими словами максимально возможным КПД при данном перепаде температур является КПД цикла Карно. Диаграмма Т-S дает наглядное доказательство этого утверждения. Любой другой цикл в диапазоне температур Т1-Т2, на диаграмме будет иметь соотношение площадей меньшее чем соотношение площадей прямоугольников. В связи с площадями на диаграмме возникло выражение - степень заполнения цикла – насколько площади работы цикла близки к площадям прямоугольников
Важным следствием из формулы для КПД цикла Карно является то, что для увеличения КПД необходимо увеличивать температуру подвода тепла T1, и снижать температуру отвода тепла T2. На любых энергетических установках, в том числе и в ТРД, использующих в качестве конечного поглотителя, тепла окружающие пространство, зимой к.п.д. выше за счет снижения температуры окружающей среды T2.
Второй закон термодинамики.
Первый закон термодинамики утверждает, что теплота может превращаться в работу, а работа в теплоту, не устанавливая условий, при которых возможны эти превращения. Повседневные наблюдения и опыты показывают, что теплота сама может переходить только от нагретых тел к более холодным (до полного равновесия). Только за счет затраты работы можно изменить направление движения теплоты. Это свойство теплоты резко отличается от работы. Работа легко и полностью превращается в теплоту.
В тепловых машинах превращение теплоты в работу происходит только при наличии разности температур между источниками теплоты и теплоприемниками. При этом вся теплота не может быть превращена в работу. Закон, позволяющий указать направление теплового потока, и устанавливающий максимально возможный предел превращения теплоты в работу в тепловых машинах - 2-й закон термодинамики.
Формулировки второго закона термодинамики:
- Вечный двигатель второго рода невозможен (под вечным двигателем второго рода понимается машина, которая могла бы превращать всю подводимую к ней теплоту в работу. Такая машина имела бы КПД = 1).
- Стопроцентное превращение теплоты в работу посредством тепловой машины - двигателя невозможно. Условия работы тепловых машин:
- Тепловая машина всегда работает в определенном перепаде температур. (Это значит, что для работы такой машины необходим иметь по крайней мере 1 источник теплоты, и 1 приемник теплоты).
- Любая тепловая машина должна работать циклично, т.е. рабочее тело, совершая за определенный промежуток времени ряд процессов расширения и сжатия, должно возвращаться в исходное состояние.